血栓闭塞性脉管炎(TAO)是一种以血管炎症和血栓形成为特征的慢性外周血管疾病,多发于吸烟的年轻男性。该病从四肢远端小血管缺血起病,表现为疼痛、发凉等症状,随着血管闭塞向近端发展,可引发溃疡、坏疽甚至截肢。当前治疗以戒烟为核心,辅以药物改善循环或手术重建血管,但存在复发率高、预后差等局限。
近年,间充质干细胞(MSCs)疗法展现出潜力,其通过分泌抗炎和促血管生成因子改善血流与组织修复。然而,缺血微环境中的高活性氧水平会降低干细胞存活率,且肌肉注射易引发免疫排斥,从而导致细胞流失,所以需反复给药。因此,开发一种能保护干细胞免受氧化损伤并增强驻留的新型递送平台,是突破治疗瓶颈的关键研究方向。
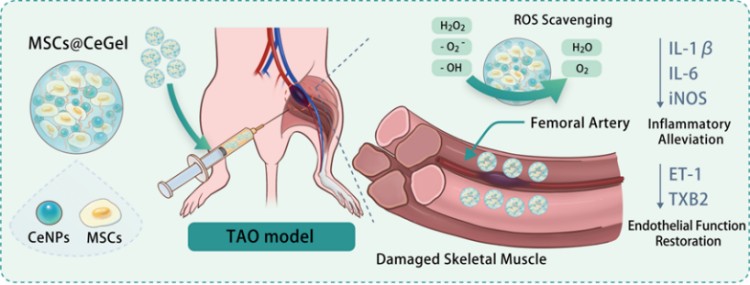
针对以上问题,中国科学院上海硅酸盐研究所陈航榕、马明团队开发了一个协同治疗平台——负载氧化铈纳米颗粒(CeNPs)的甲基丙烯酸明胶(GelMA)的水凝胶微球(CeGel),用于MSCs的递送以治疗TAO。相关成果以“Cerium Nanozyme-Powered Hydrogel Microspheres Alleviate Thromboangiitis Obliterans via Enhanced Stem Cell Therapy”为题发表在学术期刊《Small》上。该研究提出了一种基于干细胞与纳米酶结合水凝胶微球整合的新型治疗方法,为TAO治疗提供了全新的思路和方法。
本研究中基于微流控技术成功构建了具有协同治疗功能的干细胞水凝胶微球体系。首先,研究团队设计出具有锐针结构(内径200 μm)的微流控芯片,并利用摩方精密面投影微立体光刻(PμSL)3D打印技术(nanoArch® S140,精度:10 μm)制作了芯片主体。微通道的几何结构对液体的流动动力学和液滴的生成有着重要影响。该锐针结构可显著增强分散相和连续相之间的界面剪切力,从而实现单分散液滴的稳定生成。随后通过沉淀法制备具有高效活性氧清除能力的CeNPs,继而通过微流控技术将CeNPs与MSCs共包封于GelMA中,构建了复合水凝胶微球MSCs@CeGel。 图. MSCs@CeGel的制备、表征和治疗机制。

随后,凭借CeNPs的多酶活性和水凝胶微球的机械支撑,在CeGel中培养的MSCs有望在TAO氧化应激环境中实现更长的保留时间和更高的存活率。此外,CeGel还能通过清除ROS重塑炎症微环境,并且促进内皮功能的恢复。团队进一步在TAO体内模型中系统评估了MSCs@CeGel的治疗潜力,结果显示复合微球通过协同治疗效应显著促进了缺血组织的血管重建和功能恢复。
总结:本研究提出了一种将微环境调控和干细胞移植相结合的协同策略,为治疗TAO及其他潜在的相关疾病提供了新的思路。 该研究成果由中国科学院上海硅酸盐研究所科研人员和学生共同完成,研究生张逸青和时章朋为发表论文的共同第一作者,马明研究员和陈航榕研究员为通讯作者。
原文链接:https://doi.org/10.1002/smll.202408748