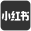3D打印技术作为先进制造手段,在生物医学领域掀起革新,尤其为微流控器件的一体化制备提供了核心技术支撑。对于罕见肿瘤病理切片的研究,样本稀缺与多维分析需求的矛盾长期存在,而高精度3D打印能精准构建复杂的微通道、反应腔等关键微结构,以及快速一次成型自定义的PDMS芯片模具,缩短制样周期并保证微通道与腔室的高重复性,为开发低样本消耗、高集成度的病理分析设备奠定了基础。针对病理切片与稀有肿瘤样本的资源稀缺问题,将微流体模块与高精度3D打印结合,能显著降低所需切片数量并提升多通道和多标记的空间分辨率,使得组织切片处理、微量试剂流控与多通道并行检测在临床和研究中更加可及,成为破解临床诊断与科研瓶颈的重要技术。
近日,海南大学的黄振立、史冰团队在《Science Advances》在线发表题为“Dual-mode microfluidic immunostaining device for diagnostic biomarkers detection and tumor microenvironment evaluation”的原创性论著,海南大学的博士研究生张瑜为本文第一作者,海南大学的史冰讲师和黄振立教授为共同通讯作者。该研究开发了双模式微流控免疫染色装置(Dumi),在1~2张组织切片上实现了免疫组织化学(IHC)标志物诊断流程与肿瘤微环境(TME)科研分析的一体化,并能构建含多个诊断标志物的空间TME图谱,便于挖掘肿瘤细胞亚群与其原位微环境的关联性。该文章为罕见肿瘤的精准诊断和TME研究提供了临床可及的高效解决方案。
首先,研究团队通过摩方精密的面投影微立体光刻(PμSL)3D打印技术(microArch® S240,精度:10 μm),制造了核心部件——3D打印流体交换歧管和微流控芯片模具,其微通道尺寸变异系数小于1%,确保了装置的结构一致性与运行稳定性。Dumi装置集成了双模式染色功能:多通道模式通过16个平行微通道,可同时检测16种诊断生物标志物;全腔室模式则能完成多轮循环迭代的免疫荧光染色,构建TME空间图谱(图1)。微流控系统的连续流动设计,将传统1小时以上的孵育时间缩短至10分钟,试剂消耗和切片使用量分别减少90%和94%以上,且可兼容常规显微成像平台。
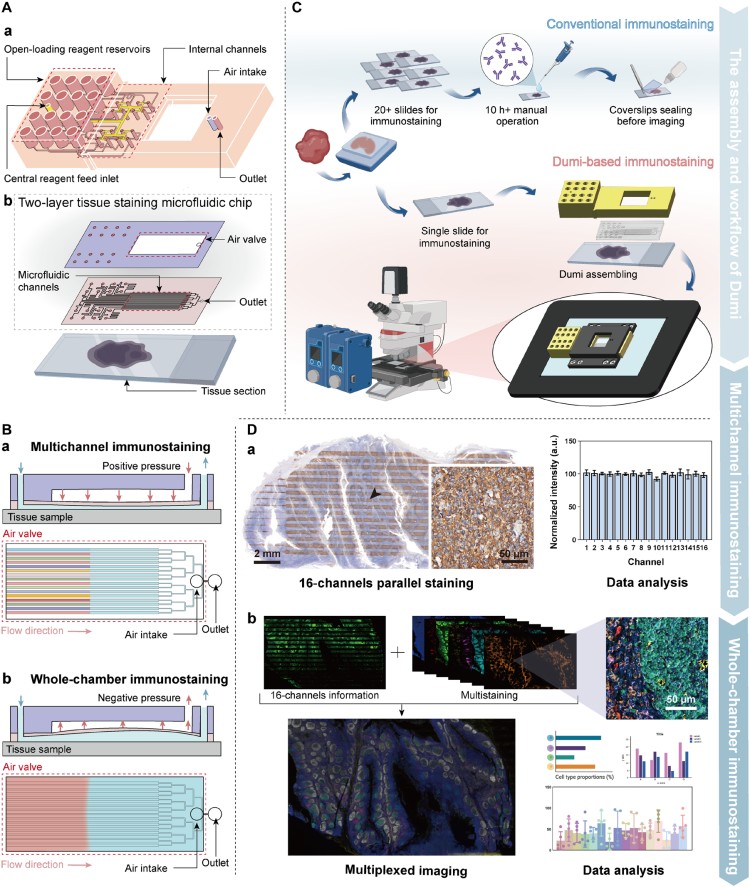
图1. Dumi装置结构、工作流程及双染色模式示意图。
为提升染色准确性,研究人员以CD20(膜标志物)和Ki67(核标志物)为对象,优化了流速和孵育时间(图2)。结果显示,4 μL/min流速、10分钟孵育时,抗原-抗体结合接近饱和(CD20达92%、Ki67达84%),且非特异性背景最低。通过抗体浓度梯度实验,验证了在常规IHC推荐浓度下,Dumi可直接使用现有抗体,无需重新优化,两种抗体的浓度-响应曲线形态相似,证明方法一致性较好。
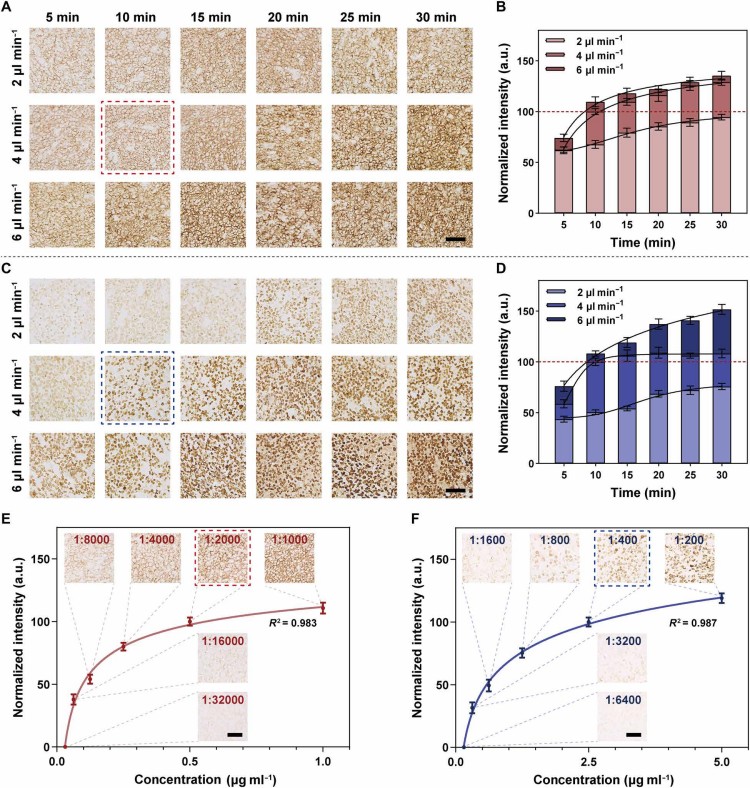
图2. Dumi免疫染色参数优化。
接下来以扁桃体组织CD20染色为模型,对比Dumi全腔室模式与传统IHC(图3)。传统IHC需235分钟,且存在明显边缘效应;Dumi仅需34分钟,且染色强度分布较为均匀。定量分析显示,Dumi的信号变异系数(<9.307%)低于传统方法(<11.450%),虽信号强度略低,但背景信号更低,信号背景比(SBR)更优,证明二者信号提取能力相当,可相互替代。
图3. 全腔室模式与传统 IHC 的性能对比。
接下来,研究人员采用扁桃体组织验证双模式连续免疫荧光染色策略,通过多通道IF预筛选生物标志物后,经光漂白处理再进行全腔室六重免疫荧光染色(图4)。对三个重复样本的分析显示,细胞表型组成高度相似,t-SNE聚类能清晰区分免疫细胞谱系。验证了Dumi在复杂流程中的稳定性和数据可靠性。
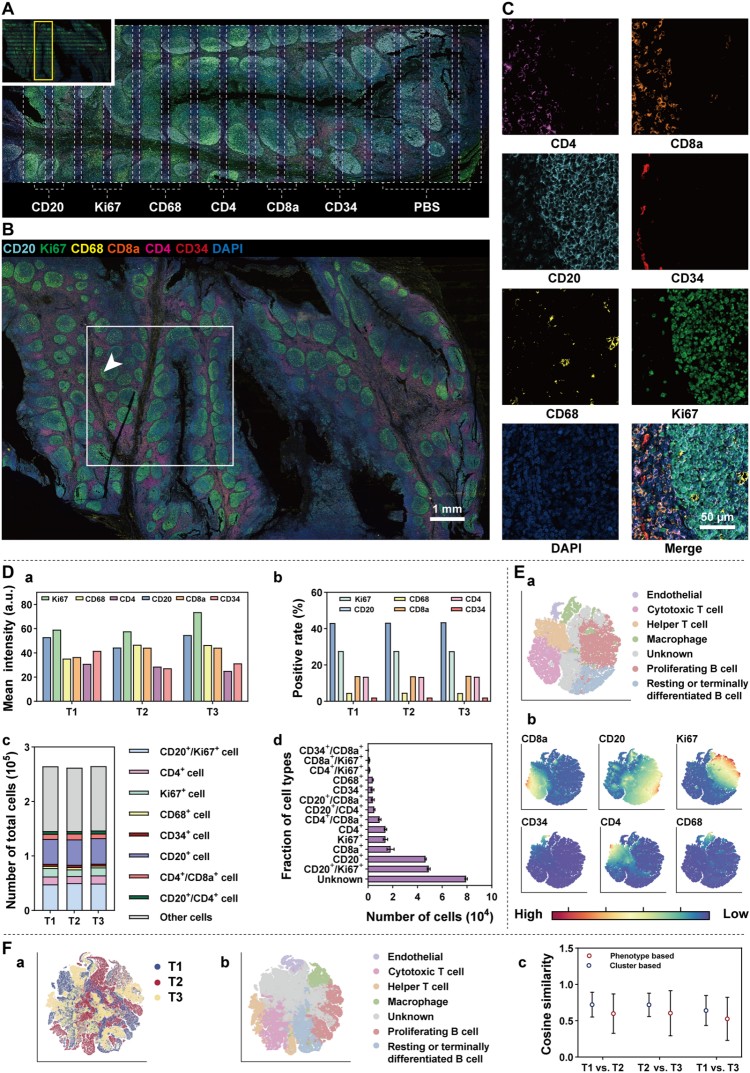
图4. 双模式连续染色的重复性与细胞分析。
在临床应用中,研究团队将Dumi用于4例弥漫大B细胞淋巴瘤(DLBCL),含1例罕见的原发于中枢神经系统弥漫大B细胞淋巴瘤(PCNS-DLBCL)。病理诊断结果显示,通过多通道模式快速完成了自动化的16种生物标志物检测,并请病理学家进行诊断,亚型诊断结果与病理报告高度一致。
基于PCNS-DLBCL样本诊断后的剩余单切片,通过全腔室模式构建六重TME图谱,涵盖肿瘤细胞、免疫细胞、血管内皮细胞等。PhenoGraph聚类成功识别出细胞毒性T细胞、辅助 T细胞等群体。空间分析显示,CD8a⁺T细胞与肿瘤细胞(CD20⁺)呈空间排斥关系,Ripley's K分析证实其在10 μm以上存在持续聚类,揭示了“免疫排斥型”TME特征,为TME研究提供了可重复的分析起点。
最后,研究人员在单一组织切片上实现多通道诊断标志物与全腔室TME图谱的联合分析。NND分析显示,CD20⁺细胞与GFAP⁺细胞、CD68⁺细胞空间距离最近(中位距离8-10 μm)。不同诊断标志物阳性细胞的微环境存在差异:如MUM1⁺、Bcl-2⁺细胞与血管内皮细胞富集,c-Myc⁺细胞则呈排斥;Bcl-6⁺/CD20⁺、c-Myc⁺/CD20⁺细胞周围的CD8a⁺ T细胞比例升高,表明特定肿瘤亚群能主动塑造其微环境生态位,为个性化诊疗提供了直观的空间证据。
总结:Dumi装置借助摩方精密微纳3D打印技术实现核心部件的高精度制备,突破性解决了罕见肿瘤样本稀缺造成信息获取不足的技术痛点。其双模式设计可通过1-2张切片完成16种标志物诊断与TME空间分析,不仅大幅降低样本消耗,节省了利用样本进行单标记预实验的筛选流程,还建立了诊断生物标志物与原位微环境的直接关联,为解析肿瘤免疫逃逸机制提供了全新方法。该设备兼容现有临床病理流程,无需复杂操作培训,为罕见肿瘤的精准诊断、预后评估和个性化治疗提供了实用工具,未来有望拓展至原位杂交、空间转录组等更多生物医学应用场景。
原文链接:https://doi.org/10.1126/sciadv.aea2586