厦门大学任磊课题组《Advanced Functional Materials》:微针机器人实现结肠给药的快速自定位和抗蠕动粘附
发布日期:2023-07-21
浏览量:628次
携带微针的微型机器人被认为是一种有前途的胃肠道给药新手段,它被设计成适应胃肠道环境的几何形状和尺寸,在电场、磁场或化学场等外部场的控制下,以类似牵线木偶的方式被推进到特定位置进行无痛和微创给药。通过微型机器人携带微针进入肠道,微针中的药物可以渗透进肠道粘膜以避免在胃肠道的高酸性和不均匀pH环境中发生降解,这种新给药方式在递送生物分子药物(如蛋白质、核酸和疫苗等)和提高疗效上具有独特的优势。然而,目前仍存在许多挑战,如复杂的控制模式、缺乏运动和粘附行为的理论、蠕动和液体流动导致的失败以及肠梗阻的风险。

近期,厦门大学任磊教授、王苗助理教授和厦门大学附属中山医院蔡顺天副主任医师团队提出了一种受不倒翁(一种被推倒时能快速恢复定位的玩具)启发的微针机器人,用于穿透结肠粘膜给药,可以免除控制系统、实现快速自我定向和粘附粘膜、对抗生理蠕动,并降低梗阻风险。该团队利用具有流线型和低重心结构的微型机器人携带微针进入斑马猪的结肠中,无需外部控制系统实现快速定向(<0.6 s)和粘膜粘附,最后从斑马猪体内安全排出。相关研究内容以“Tumbler-Inspired Microneedle Containing Robots: Achieving Rapid Self-Orientation and Peristalsis-Resistant Adhesion for Colonic Administration”为题发表在《Advanced Functional Materials》期刊上,厦门大学在读博士生黄丽冰为第一作者。
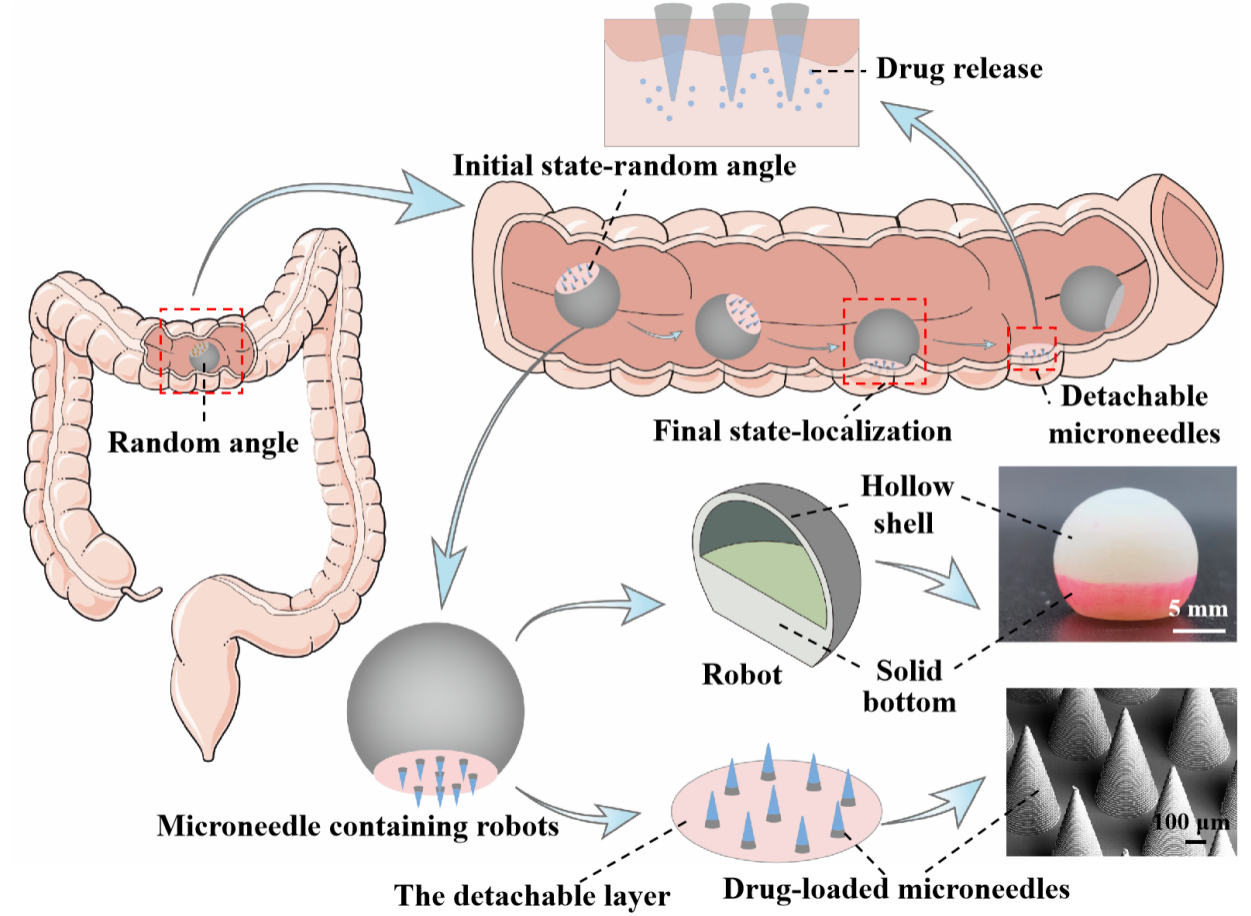
图1. 基于3D打印的微针机器人的快速自定向和结肠给药机制。
该研究构建了一种在毫秒内自导向的微针机器人。如图1所示,它由机器人、微针阵列和可分离层组成,用于结肠给药。团队成员使用摩方精密公司的nanoArch S140 微纳3D打印机制造微米级别的微针阵列,微针底座300 μm,长600 μm,微针间距450 μm,在SEM图像中展示出良好的形貌和阵列分布。该微针阵列用于负载不同浓度的亚甲基蓝染料,探究用于结肠控制释药的微针阵列制造的优化策略。将优化后的微针阵列通过生物降解聚合物制备的可分离层连接在3D打印机器人底部,最终制备得到微针机器人。
研究人员将微针机器人以随机的角度放入结肠,由于3D一体打印的机器人的重心较低,可以快速自我定向垂直于粘膜。微针阵列在机器人重力和结肠蠕动力的合力作用下逐渐穿透粘膜,通过开发的拉力模型合理评估出插入的微针机器人在不脱离粘膜的情况下对结肠蠕动的阻力约为1.75N,这足以抵抗结肠蠕动产生的推力(通过计算约为0.95N),使其成功驻留在结肠组织中以持续释药。体外停留实验发现机器人和微针阵列之间的可分离层降解后,与微针阵列分离的机器人在构建的体外结肠仿真模型和COMSOL流-固模型中都证实了可以在流体流动引起的20 mN的小排泄力下安全排出。为了进一步验证微针机器人的有效性和可行性,将含有微针的机器人注入斑马猪的结肠,通过结肠镜观察到在5 s内实现了自我定位,在重力和结肠蠕动力作用下将微针插入粘膜,微针和机器人之间的可分离层可以在80 s的时间内降解,机器人从嵌入粘膜的微针阵列中分离出来,并从结肠排出。插入的微针被保留在粘膜中,以便在负载药物缓慢溶解时释放该药物。与先前报道的其他系统相比,该工作提出的微针机器人结构简单,不需要外部场控制,可以克服结肠蠕动并降低了结肠阻塞的风险,作为治疗慢性炎症和结肠癌等疾病的通用给药平台方面具有巨大应用潜力。
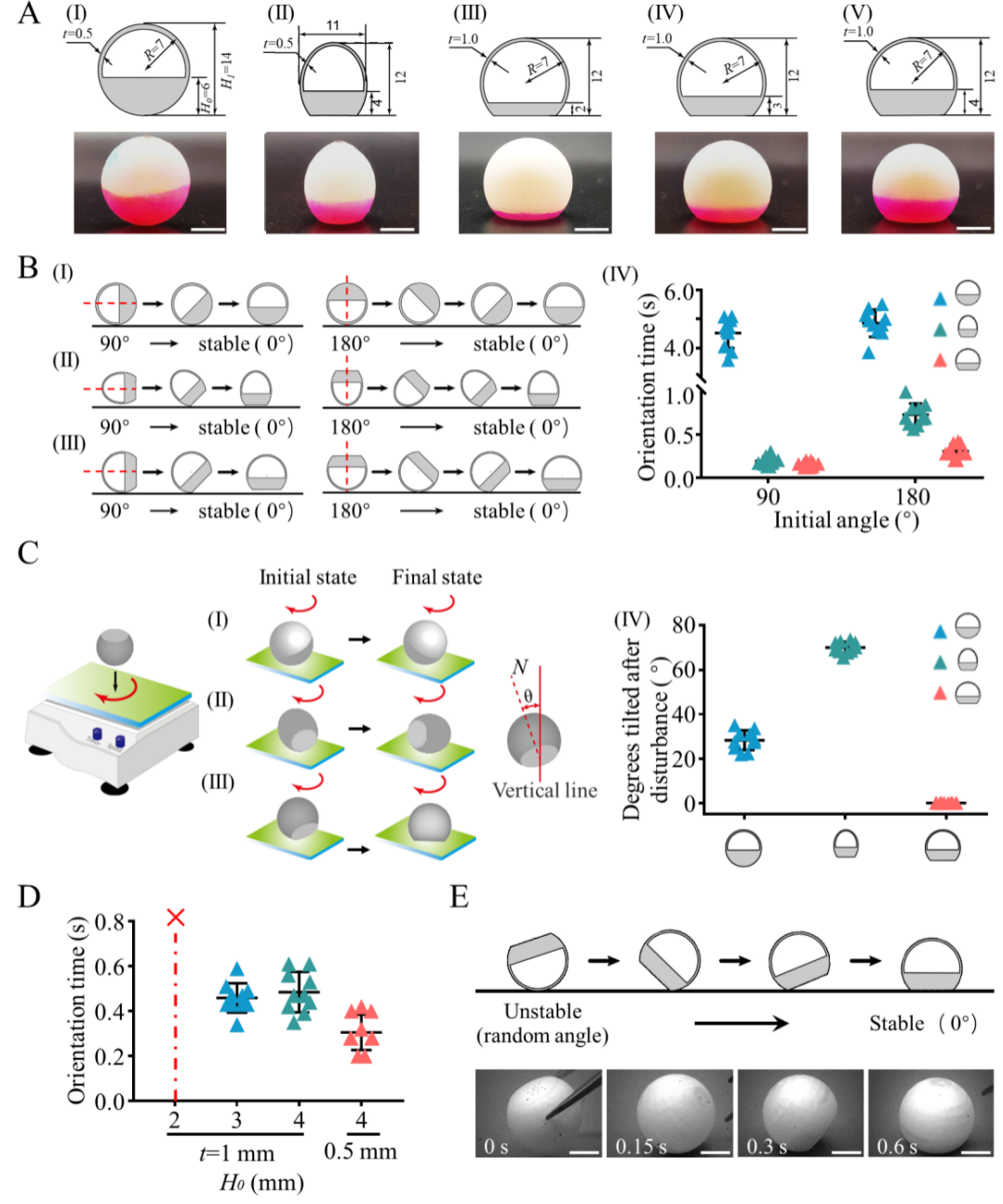
图2. 基于3D打印的微型机器人的参数优化。(a)半球、球形和椭球形三种形状和不同底座高度的半球形机器人(I-V)。(b)初始角度为90°和180°对不同形状的机器人(I-III)的自我定位时间(IV)的影响。(c) 不同形状的机器人在70 rpm的水平振动器上的稳定性,扰动后的最大偏差角度(IV)。(d) 具有不同底座高度和外壳厚度的半球形状机器人的定向时间。(e)参数优化后的机器人在随机角度下的自我定向时间。
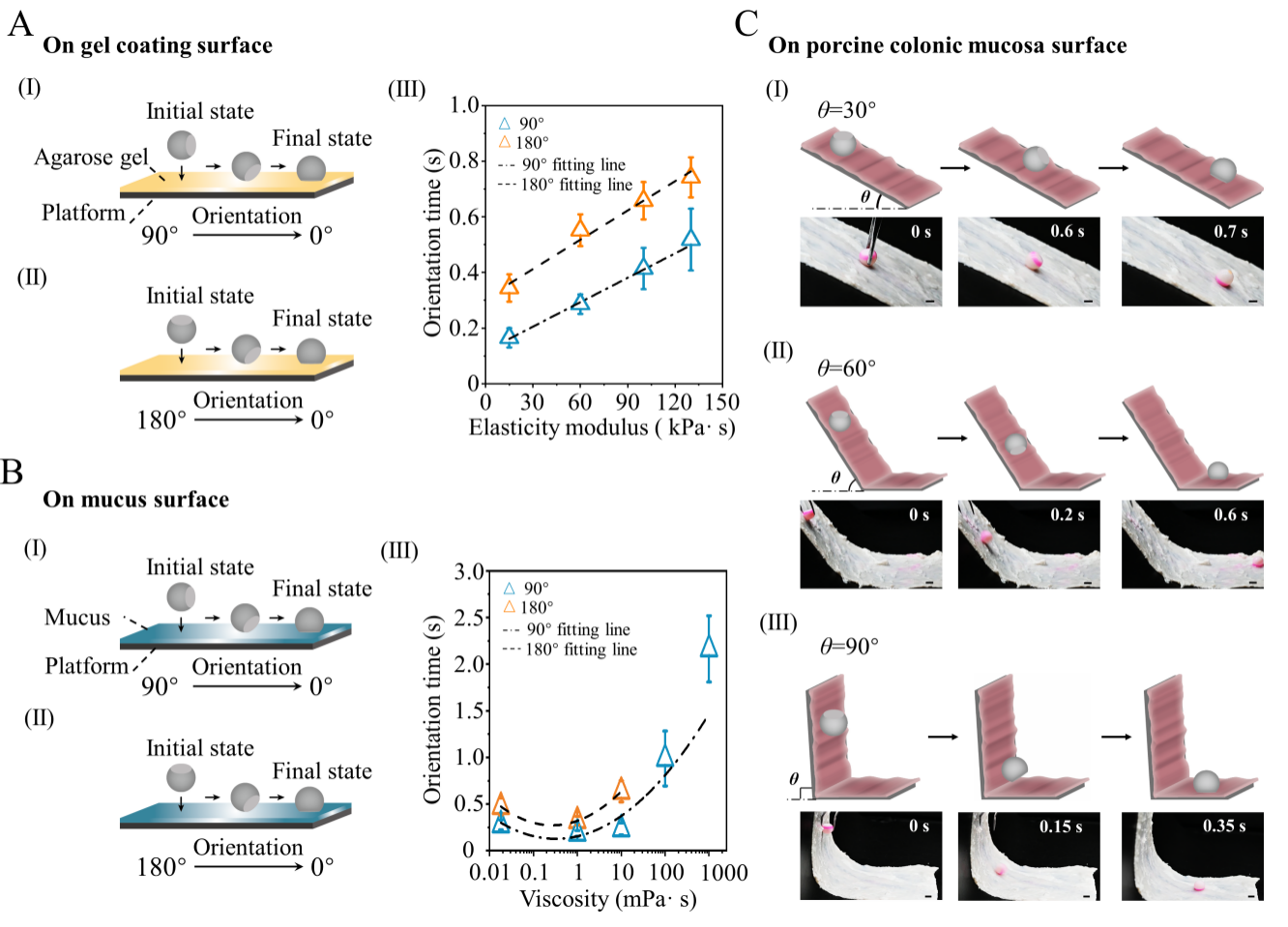
图3. 机器人在不同表面上的自定向性能。(a)初始角度为90°(I)和180°(II)的微针机器人在具有不同弹性模量(III)的琼脂糖凝胶表面上的定向时间。(b)初始角度为90°(I)和180°(II)的微针机器人在不同粘度(III)的粘液表面上的定向时间。(c)机器人在斜率为30°(I)、60°(II)和90°(III)的猪结肠粘膜上的自定向时间。
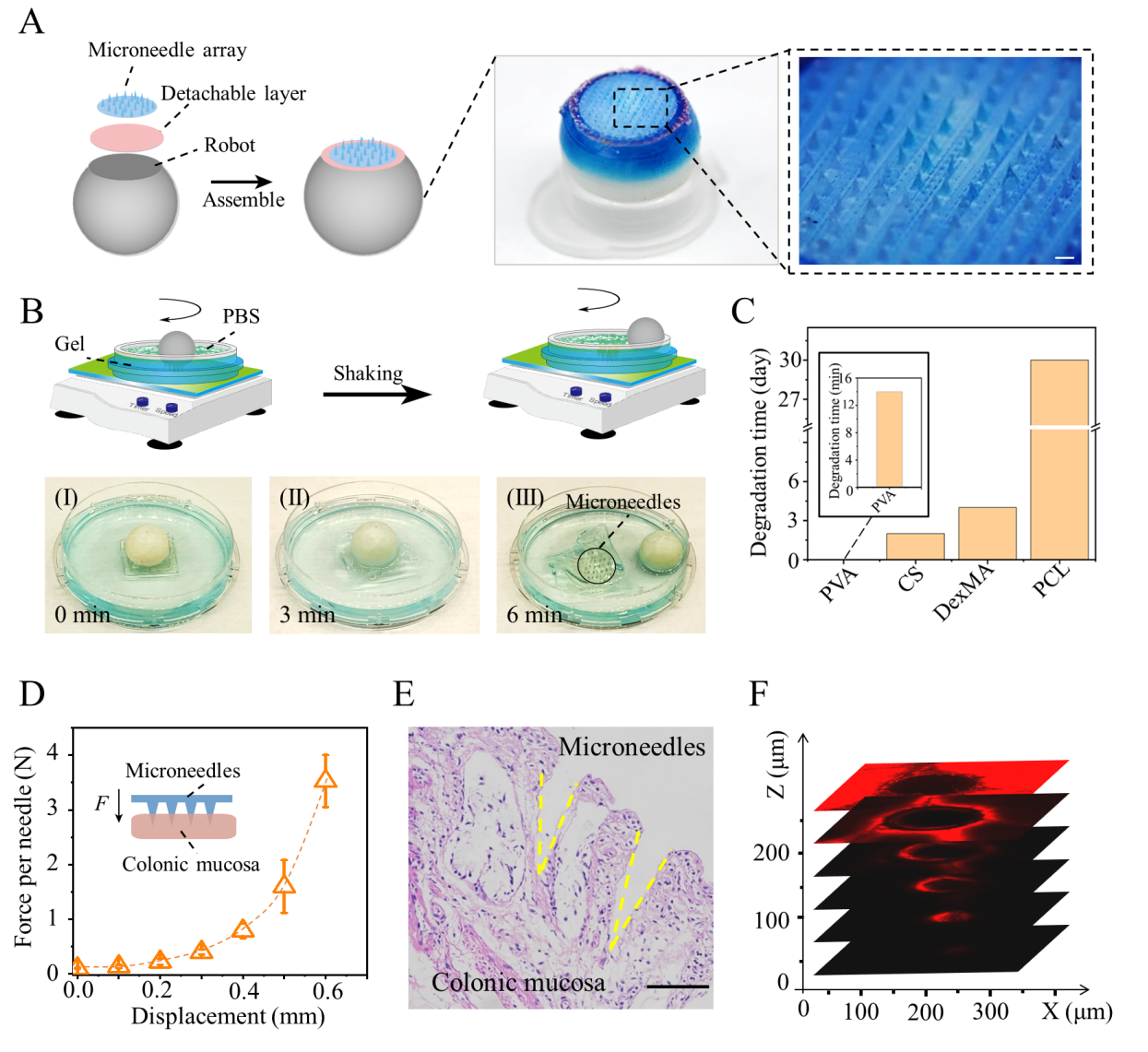
图4. 可拆卸微针机器人的设计与优化。(a)可分离的微针机器人的设计和组装。(b)由可分离层(I-III)的降解引起的微针机器人的体外分离实验。(c)PVA、CS、DexMA和PCL微针在PBS缓冲液中的体外累积释放时间。(d)对微针施加的力及其穿透粘膜的深度。(e)微针插入后的体外猪结肠组织切片图像(H&E染色法)。(f)Cyanine5.5染色的微针插入结肠组织的共聚焦显微图像。
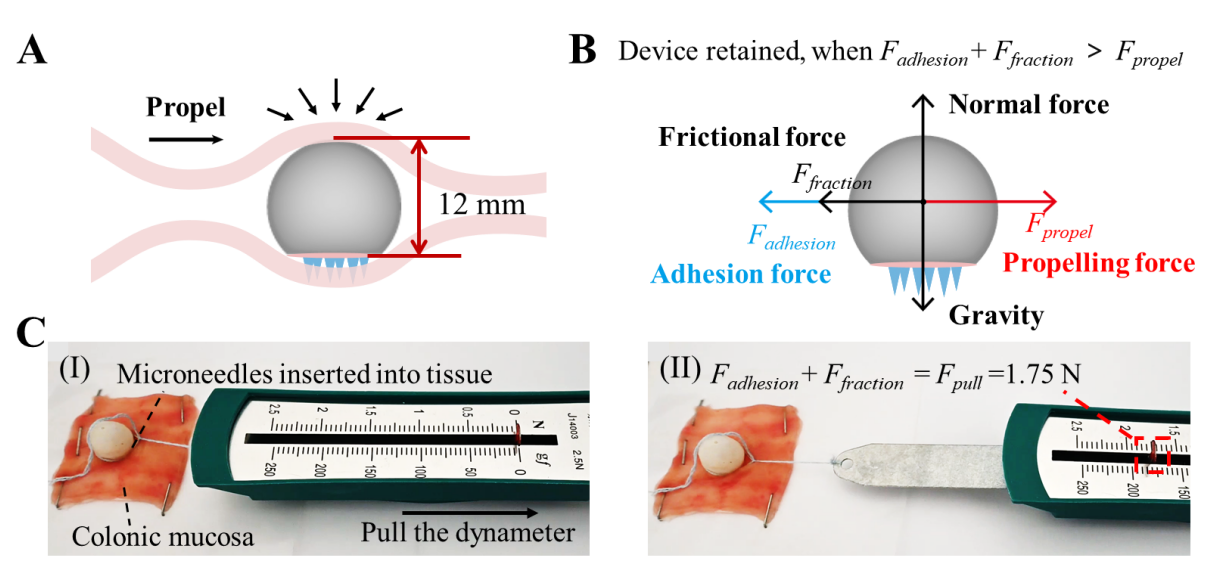
图5. 微针机器人抵抗结肠蠕动的理论模型。(a)在结肠蠕动下刺入粘膜的微针机器人的示意图。(b)结肠蠕动时腔内微针机器人的受力分析。(c)微针机器人被牵拉前(I)和牵拉后(II)的拉力示数。
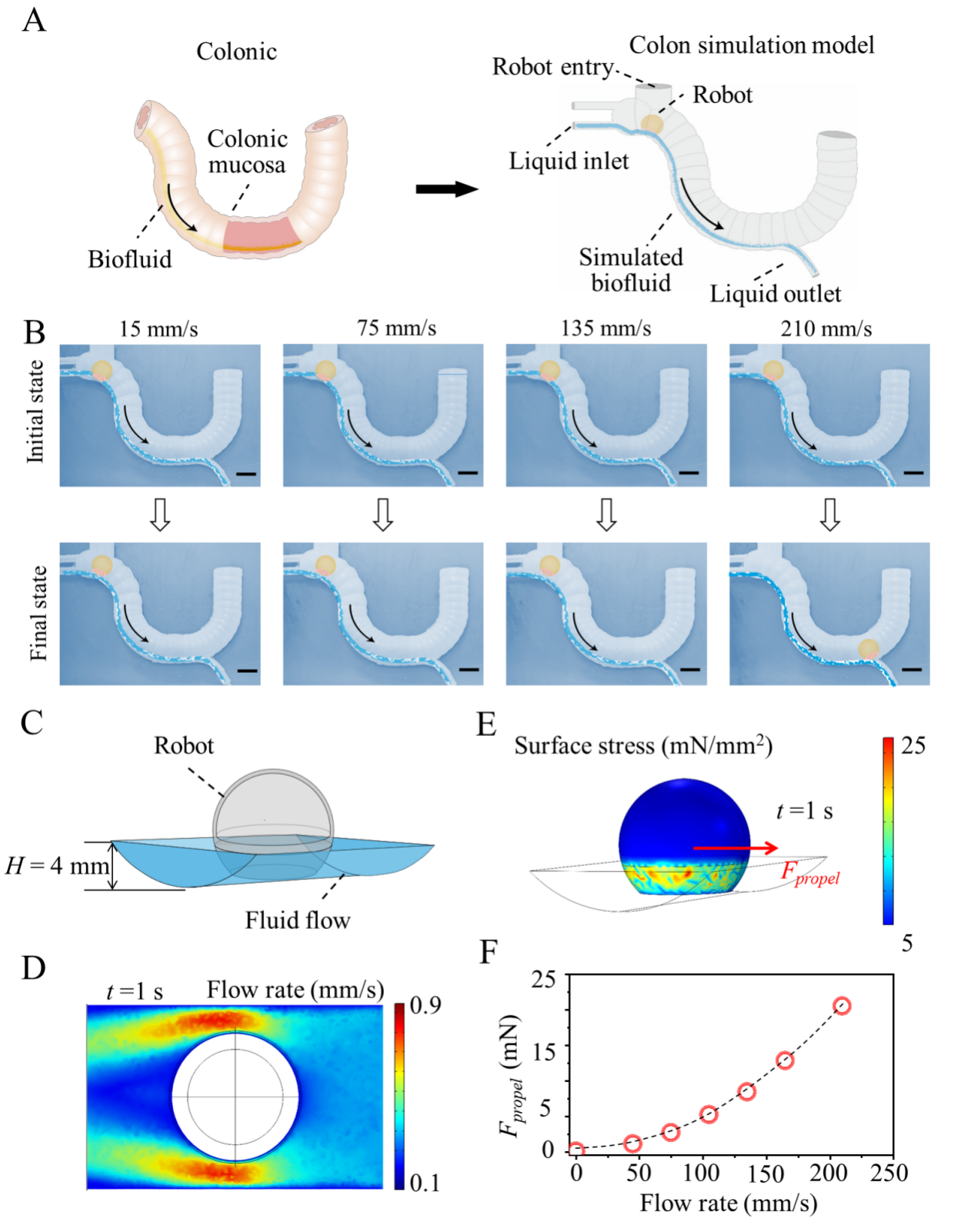
图6. 微针机器人的体外停留实验与模拟。(a)模仿人类结肠的软胶模型。(b)不同流速下机器人的运动。(c)构建机器人的有限元流-固模型,流速为210 mm/s时机器人周围的(d)流速分布和(e)表面应力,以及(f)不同流速对机器人的推进力。
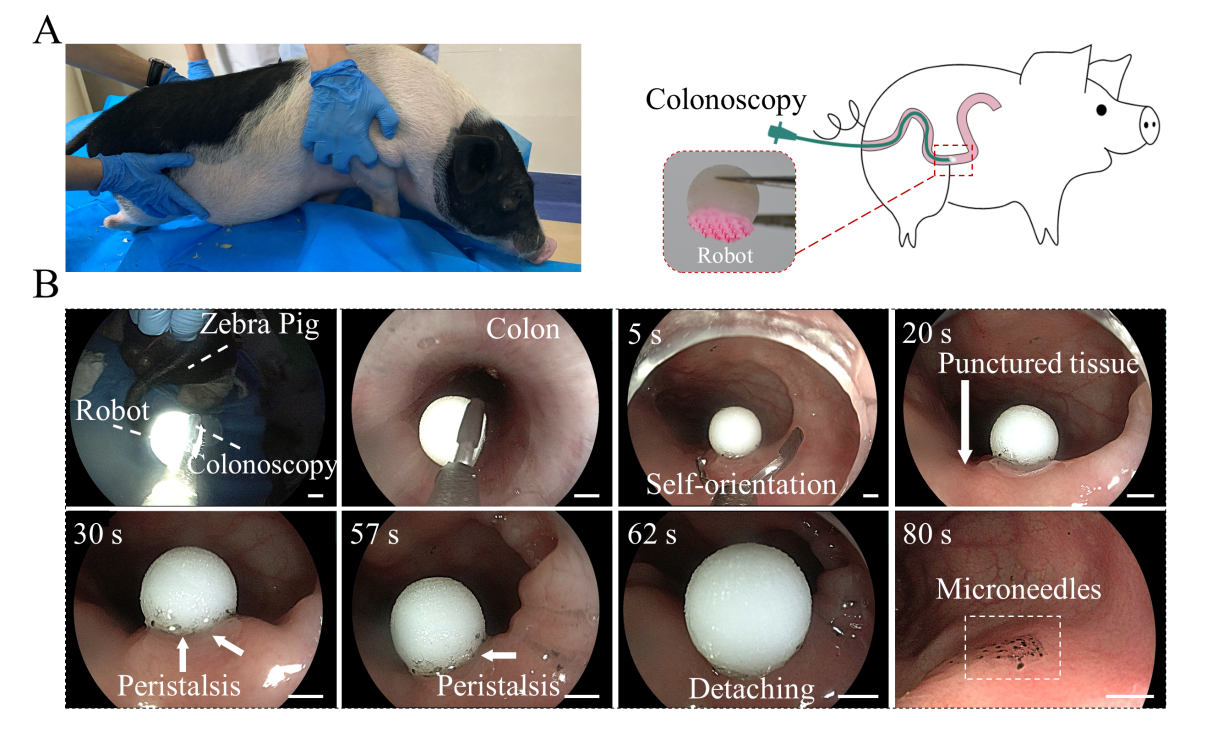
图7. 微针机器人的斑马猪体内实验。(a)斑马猪的照片和微针机器人进入结肠的输送示意图。(b)微针机器人在斑马猪结肠腔内的实验照片。
原文链接:
https://doi.org/10.1002/adfm.202304276