在乳腺癌化疗中,阿霉素因其强效性被广泛使用,然而高达50%患者会出现耐药反应,导致疗效骤降,预后不佳。其耐药机制较为复杂,尤其是与线粒体代谢重编程密切相关。
近日,武汉大学药学院黎威教授团队与武汉大学生命科学学院宋质银教授团队合作在《ACS Nano》期刊发表题为:“Mitochondria-Targeted Microneedles Reverse Doxorubicin Resistance via Apoptosis-Ferroptosis Synergy”的研究论文,提出一种创新策略——基于线粒体靶向微针(HDT-Z@MNs)系统,精准激活癌细胞“死亡开关”,打破乳腺癌阿霉素耐药困局。武汉大学药学院博士后郝天书和武汉大学生命科学学院博士研究生郭瀚泽为共同第一作者,武汉大学药学院黎威教授、武汉大学生命科学学院宋质银教授和武汉大学中南医院侯晋轩主任为共同通讯作者。
研究团队首先合成了DOX-TPP@ZIF-67 NPs。首先,将硝酸钴和2-甲基咪唑在水中反应,形成紫色的ZIF-67纳米颗粒。然后将带有三苯基膦(TPP)的DOX溶于水中,加入到ZIF-67中,利用其孔结构和表面电荷吸附药物,在pH约6.5–7的条件下反应72小时,获得中空结构的DOX-TPP@ZIF-67 NPs。TEM和SEM图像显示颗粒约为210 nm;N₂吸附-脱附测试显示具有介孔结构,表明药物已装载;装药后比表面积与孔体积略有降低,验证了载药效果;BJH分析显示孔径集中在约2 nm和60 nm。ZIF-67的钴离子中心具有催化分解H₂O₂的功能,可使纳米粒子在富含H₂O₂的环境中实现推进;在不同浓度H₂O₂中观察到粒子运动轨迹增强、扩散速率增快、均方位移(MSD)升高;表明其可作为“纳米马达”,在肿瘤等富H₂O₂微环境中增强药物富集。药物释放在酸性环境(pH 5.5)和高H₂O₂浓度下显著加快;表明其具有pH和H₂O₂响应性,适合于肿瘤微环境中的靶向药物释放 (图1)。
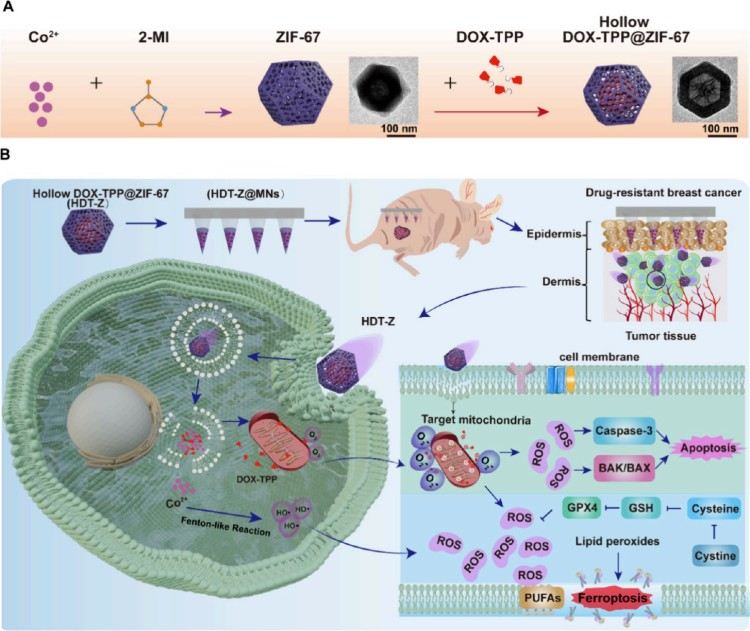
图1. 表征,药物装载,和空心DOX-TPP@ZIF-67 NPs和NPs运动的药物释放谱。(A)中空DOX-TPP@ZIF-67 NPs的制备流程图。(B) ZIF-67 NPs和空心DOX-TPP@ZIF-67 NPs的透射电镜(TEM)和(C−D)扫描电镜(SEM)图像。三张单独的TEM图像被包括在内,以呈现不同的视角和不同程度的结构破坏(D)。(E) ZIF-67 NPs和空心DOXTPP@ZIF-67 NPs的BET分析。(F)在不同H2O2浓度的PBS溶液中,ZIF-67@DOX-TPP NPs在2 s内的代表性轨迹。(G)速度测量以mean±SEM表示,n = 15。(H)中空DOX-TPP@ZIF-67 NPs的均方位移(MSD)分析。(I−J)不同pH条件(I)和不同H2O2浓度(J)下NPs中DOX-TPP的累积释放量(n = 3;平均值±SEM)。所有柱状图表示均数±SEM, n = 3个独立实验,采用单因素方差分析和Tukey多重比较检验来评估组间的统计学显著性。P值如图所示。
该微针阵列是利用摩方精密microArch® S240 (精度:10 μm)3D打印设备加工模具后经PDMS翻模制备而成的。首先将药物负载的纳米颗粒(DOX-TPP@ZIF-67 NPs)与PVA/蔗糖基质混合,涂覆到PDMS模具中以形成可溶性微针;然后通过第二次浇铸聚苯乙烯(PS)形成微针背板层。微针阵列为10×10排列,每根针的高度为850 μm,针底直径为400 μm,针间距为700 μm;PVA/蔗糖用于制针头,因其良好的机械性和水溶性;PS用于背板,增强化学稳定性并降低成本;元素分布图显示微针中C、O、Co分布均匀,扫描区域中P含量为0.33%,证明药物负载成功。
力学测试显示每根微针可承受最高0.62 N压力,足以穿透皮肤。在猪皮肤外植体测试中,微针可在表皮留下均匀孔洞,表现出良好的穿透性能;冷冻切片分析显示药物能够有效穿透皮肤层;OCT成像证实微针可穿透皮肤至少300 μm深度,进一步验证其优越的透皮递送能力。所构建的HDT-Z@MNs结构合理、力学性能良好,药物成功集中装载于针尖,在猪皮模型中表现出优异的穿透力和药物输送效率,为肿瘤局部治疗提供了可靠的经皮给药平台(图2)。
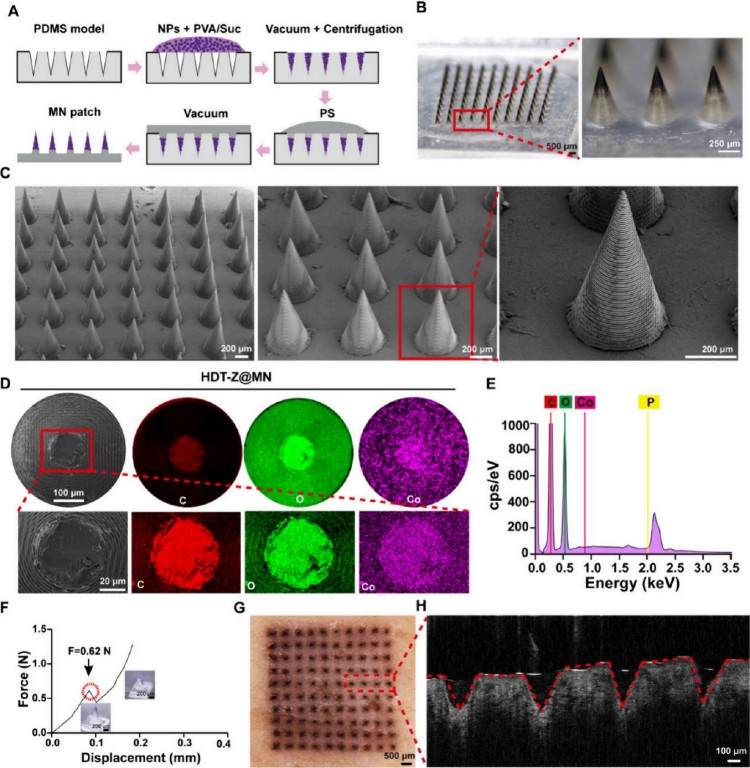
图2. 中空DOX-TPP@ZIF-67纳米颗粒负载纳米颗粒的表征(HDT-Z@MNs)。(A) HDT-Z@MNs制备模式图。(B) HDT-Z@MNs的代表性光学显微镜图像。(C)扫描电镜图像的HDT-Z@MNs阵列与一个单一的MN在最右边。(D-E)单个MN的SEM截面图,(D) MN尖端截面积中C、O、Co的元素分布,以及尖端截面积的EDS点分析图(E)。(F) HDT-Z@MNs的力-位移曲线。(G-H) HDT-Z@MNs穿刺离体猪皮的代表性明场显微镜图像(G)和光学相关断层扫描结构图像(H)。
药物载体通过能量依赖性胞吞被细胞内吞,首先定位于内体,随后转运至溶酶体释放药物,药物最终进入胞质并向线粒体靶向递送;TEM图像确认纳米粒子被细胞摄取,并定位于溶酶体中;TPP⁺是一种疏水阳离子,易在线粒体负膜电位驱动下富集在线粒体;在MCF-7/DOX细胞中共孵育2、4、8、12小时,观察DOX与线粒体共定位;共定位率随时间增加,12小时时HDT-Z@MNs组最高(0.71),明显优于:D@MNs(自由DOX@MNs);DT@MNs(DOX-TPP@MNs);HD-Z@MNs(中空DOX@ZIF-67 MNs)优势归因于:ZIF-67提供的载体结构与运动能力;TPP⁺赋予的线粒体靶向特性。HDT-Z@MNs通过纳米马达运动性与TPP⁺介导的线粒体靶向双重机制,实现高效胞内递送与线粒体定位,尤其在DOX耐药乳腺癌细胞中显示出增强的细胞摄取与线粒体富集能力,为耐药性乳腺癌治疗提供了新的策略和突破点(图3)。
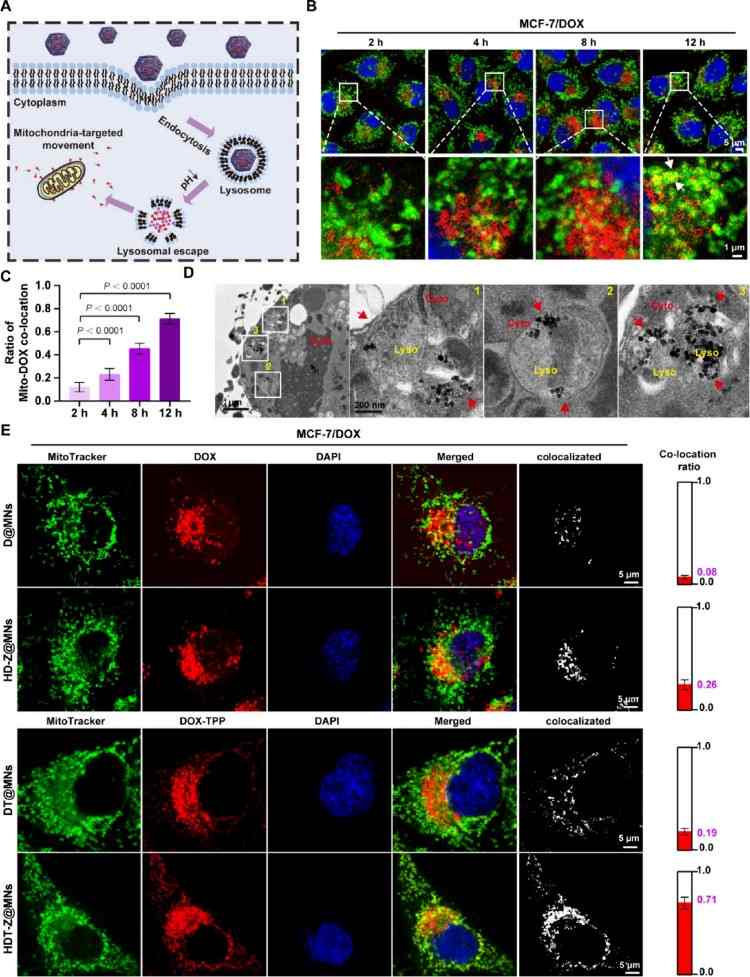
图3. 中空DOX-TPP@ZIF-67的细胞内摄取和线粒体靶向。(A)肿瘤细胞内NPs运动示意图。(B-C)经HDT-Z@MNs处理2、4、8和12小时的MCF-7/DOX细胞。细胞核和线粒体分别用Hoechst 33342(蓝色)和Mtio-Tracker Green染料染色,共聚焦显微镜观察线粒体和NPs共定位图像(B), (C)柱状图中显示的共定位比代表使用ImageJ中的Coloc2插件计算的Manders '重叠系数(MOC)。(D)对经HDT-Z@MNs处理12 h的MCF-7/DOX细胞进行超薄切片,透射电镜观察细胞对DOX/DOX-TPP的摄取过程。(E)分别在MCF-7/DOX细胞中孵育12 h后,D@MNs、DT@MNs、HD-Z@MNs和HDT-Z@MNs与线粒体共定位的荧光图像。
细胞核用Hoechst 33342染色(蓝色),线粒体用Mito-Tracker Green FM标记(绿色)。红色荧光表示DOX或DOX-TPP。右边的白色荧光表示与线粒体共定位的部分,最右边的列表示MCF-7/DOX细胞质溶胶中计算出的线粒体和DOX共定位的比例。共定位比用Manders系数表示,使用ImageJ中的Coloc2插件计算。所有柱状图表示均数±标准差,n = 3个独立实验,采用单因素方差分析后采用Tukey多重比较检验来评估组间的统计学显著性。P值如图所示。
细胞存活实验显示:在2、4、8 μg/mL浓度下,HDT-Z@MNs对MCF-7/DOX细胞具有最强毒性,IC50为4 μg/mL,优于其他对照组;克隆形成实验进一步表明,HDT-Z@MNs处理后,MCF-7/DOX细胞的克隆显著减少,且结构松散;Live/dead染色显示HDT-Z@MNs对细胞均具明显毒性。划痕实验评估细胞迁移:HDT-Z@MNs处理后,MCF-7/DOX细胞的伤口闭合率仅20.1%;在含Matrigel的模型中,HDT-Z@MNs组细胞侵袭能力最低;表明该系统显著抑制乳腺癌细胞迁移和侵袭能力。HDT-Z@MNs通过线粒体靶向递药,有效增强阿霉素敏感与耐药乳腺癌细胞的线粒体损伤与凋亡,显著抑制肿瘤细胞的增殖、迁移和侵袭能力。这为抗癌与抗转移治疗提供了一种高效且精准的化疗策略,尤其在耐药性乳腺癌治疗中展现出突破性潜力(图4)。
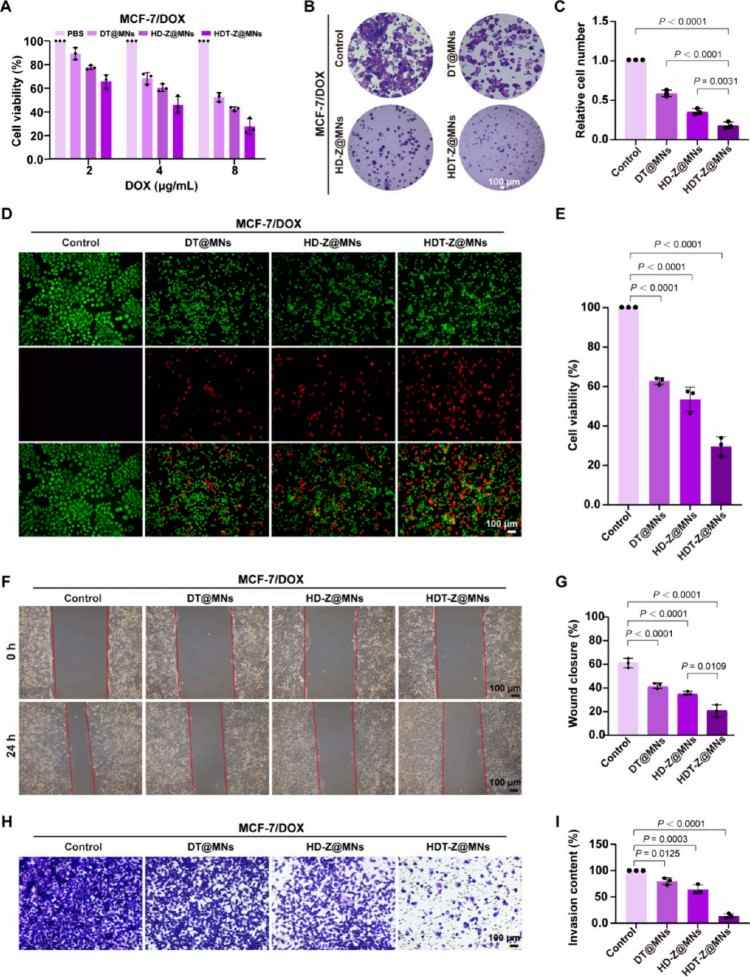
图4. HDT-Z@MNs对癌细胞死亡和抑制转移的体外评价。(A) MCF-7/DOX细胞与HDT-Z@MNs等孵育48小时后的细胞活力。(B)平板克隆实验中MCF-7/DOX细胞经HDT-Z@MNs等处理后形成的细胞簇图像和(C)细胞簇率。(D)不同处理后MCF-7/DOX细胞的活/死染色。DOX浓度在所有组中一致。绿色荧光(Calcein-AM)表示活细胞,红色荧光(碘化丙啶,PI)表示死细胞,(E)表示细胞存活率。光学图像显示体外伤口愈合试验和(F)相应的伤口愈合百分比。MCF-7/DOX细胞贴壁后(0 h)通过绘制均匀的细胞间隙建立伤口(G)。HDT-Z@MNs等与细胞共孵育24小时后检测伤口愈合百分比(E)。(h)不同MN贴片处理后MCF-7/DOX细胞穿过Matrigel屏障的代表性图像,以及(I)所示侵袭率的量化。所有柱状图表示均数±标准差,n = 3个独立实验,采用单因素方差分析后采用Tukey多重比较检验来评估组间的统计学显著性。P值如图所示。
全程小鼠体重稳定,提示整体治疗方案安全性良好。抗肿瘤疗效显著(MCF-7/DOX 和 MCF-7模型):MCF-7/DOX小鼠模型中,HDT-Z@MNs组肿瘤抑制最明显,治疗21天后肿瘤体积为初始的1倍以内,优于DT@MNs与HD-Z@MNs;肿瘤重量最小,且组织成像显示药物精确递送至肿瘤组织内部至少100 μm;生存期延长显著:60%小鼠生存超48天,而对照组31天内全部死亡;诱导凋亡, HDT-Z@MNs诱导细胞坏死/凋亡,并抑制增殖; HDT-Z@MNs能提高上皮标志物E-cadherin表达,降低N-cadherin和Vimentin表达,提示其有效抑制EMT过程,具有抗转移潜力。组织病理学分析表明主要器官未见明显损伤,表明全身毒性可控。
HDT-Z@MNs在阿霉素敏感与耐药性乳腺癌模型中表现出显著的肿瘤抑制、延长生存、抑制转移及良好的安全性,为耐药性肿瘤提供了一种有前景的线粒体靶向化疗策略。后续研究应着重于多次给药、联合治疗策略以及与传统给药方式的系统比较。 图5. 在皮下耐药乳腺癌模型中评估HDT-Z@MNs的体内抗肿瘤功效。
对MCF-7和MCF-7/DOX细胞(未处理及HDT-Z@MNs处理)进行定量能量代谢分析与广泛靶向脂质代谢组学分析;主成分分析(PCA)显示四组代谢轮廓显著分离,共鉴定出692种代谢物差异;PC、PE、PS和TG是主要的脂质亚类成分;代谢通路富集分析表明HDT-Z@MNs可激活与细胞死亡密切相关的脂质代谢通路;能量代谢分析揭示其诱导碳代谢、核苷酸代谢、TCA循环等关键通路的重构。磷酸乙醇胺积累导致线粒体膜完整性破坏:磷酸乙醇胺是合成PE的重要中间体,其水平升高可影响线粒体膜脂组成,破坏外膜结构,从而触发线粒体介导的细胞凋亡;在TPP修饰的线粒体靶向药物DOX-TPP存在下,这种损伤进一步加剧。HDT-Z@MNs处理后,Bax(促凋亡)上调、Bcl-2(抗凋亡)下调,导致线粒体外膜通透性增加;随后细胞色素c释放,诱导Caspase级联反应,激活Caspase-3裂解;同时,流式细胞术显示HDT-Z@MNs诱导的晚期凋亡水平是其他对照组的1.5~4倍。HDT-Z@MNs通过精准递送DOX-TPP至线粒体,结合脂质代谢异常与能量通路重编程,高效诱导线粒体介导的凋亡,为解决耐药性乳腺癌提供了靶向性强、机制明确的治疗新策略,进一步验证了线粒体靶向药物递送系统在克服肿瘤耐药中的独特优势。
总结:这项研究不仅展示了微针系统的高度可控性与安全性,也提出了以线粒体为新兴靶点的多重协同治疗策略,为乳腺癌及其他耐药性实体瘤的临床治疗提供了新方向。
原文链接:https://doi.org/10.1021/acsnano.5c06302