中大王山峰团队《Adv. Healthc. Mater.》:PμSL打印新型聚酯生物弹性体以提供组织修复新策略和新机制
发布日期:2024-01-29
浏览量:1254次
面投影微立体光刻(PμSL)技术具有高分辨率、可成型复杂三维结构及优异表面质量等优点。尽管PµSL技术在打印精度和速度方面占优势,但要使用具有适宜粘度的可降解树脂制造出含有三维复杂结构的弹性体,仍具有挑战性。中山大学王山峰教授课题组先前开发了一系列可光固化聚酯如聚己内酯(PCL)丙烯酸酯、PCL富马酸酯和聚富马酸丙二醇酯-co-聚己内酯共聚物(PPF-co-PCL),并将其制成三维结构。然而,由于较高的结晶度和交联密度,上述材料中用作生物弹性体上将受限。聚三亚甲基碳酸酯(PTMC)是一种室温下无定形聚合物,玻璃化转变温度(Tg)较低,极限Tg约-17℃,将对新型生物材料用于组织修复的设计策略提供重要思路。
近日,中山大学材料科学与工程学院王山峰教授团队创新性地将PTMC与富马酰氯经一步缩聚反应制备了一种新型的可光固化聚合物:聚三亚甲基碳酸酯富马酸酯(PTMCF)。PTMCF可用模具法或PμSL技术制备具有不同模量的可生物降解弹性体二维基底和三维支架。PTMCF网络具有简易合成、透明、可打印性、可生物降解性、优异的拉伸模量和断裂伸长率等特点,总体上优于大多数已报道的弹性体。此外,将模量与其它因素包括表面拓扑结构和表面化学性质解耦后,PTMCF可被用于研究单因素变量模量对体外人源间充质干细胞行为以及体内软硬组织再生的影响。相关成果以“Opposite Mechanical Preference of Bone/Nerve Regeneration in 3D-printed Bioelastomeric Scaffolds/Conduits Consistently Correlated with YAP-Mediated Stem Cell Osteo/Neuro-genesis”为题发表在《Advanced Healthcare Materials》上。文章第一作者为中山大学材料科学与工程学院2019级博士毕业生成肖鹏,主通讯作者为其导师王山峰教授。该研究得到中国国家自然科学基金(51973242和81602205)和中山大学“百人计划”启动经费的支持。
本工作通过二甘醇的双羟基引发TMC单体开环聚合制备了目标分子量分别为500 g/mol、1000 g/mol和2000g/mol的线性PTMC,随后在缚酸剂碳酸钾的存在下与富马酰氯进行缩合反应,合成了无色的线性PTMCF0.5k、1k和2k。同一聚合物的零剪切粘度(η0)随温度升高而降低,而η0随PTMCF分子量增加而增加。PTMCF中较高密度的碳碳双键可以保证打印的流畅性。打印流程图以及树脂配方如图1a所示,由于PTMCF0.5k的超低粘度,其树脂中的聚合物成分可高达90%。这一数值要显著高于现有的许多树脂,如聚富马酸丙二醇酯/富马酸二乙酯(50%),聚癸二酸甘油酯丙烯酸酯/二甲基亚砜(60%)此外,除了添加稀释剂,采用热辅助立体光刻技术,即打印时升温可以实现无溶剂打印。在这里,PTMCF0.5k可在40~45℃下进行打印,该打印温度也显著低于文献中的PTMC三甲基丙烯酸酯(60℃)和P(LLA-co-CL)甲基丙烯酸酯(80℃)。PTMCF0.5k和2k的打印工作曲线如图1b所示,20 μm层厚的临界固化能量Ec分别为58和90 mJ/cm2。为了确保层与层间的连接性以及打印结构的完整性,由于PTMCF0.5k和2k交联后均具有相对较低的模量,这里作者选用较高的能量来固化PTMCF0.5k和2k树脂(290和450 mJ/cm2,Ec对应的Cd分别为110 μm和165 μm)。
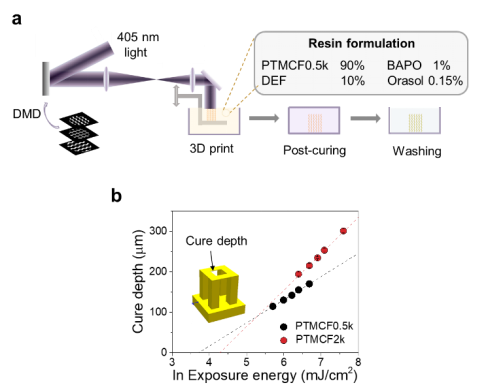
图1. (a)PµSL技术的打印示意图以及流程图;(b)两种PTMCF树脂的打印工作曲线。
团队优化聚合物树脂配方以及打印参数后采用摩方精密nanoArch® S140(精度:10 μm)打印了高分辨率的三维gyroid结构、单通道神经导管和血管网络(图2a)。PTMCF0.5k和2k gyroid支架的压缩模量分别为580 ± 90和85 ± 13 kPa(图2b)。PTMCF0.5k和2k神经导管的法向刚度分别为8.5 ± 1.4和1.6 ± 0.3 N/mm(图2c)。其中,PTMCF2k神经导管设计内外径和实际内外径分别为1.20 mm、2.00 mm和1.10 ± 0.06 mm、1.94 ± 0.03 mm。导管的弹性及抗撕裂性对体内植入时以及植入后损伤区域受到的弯曲、动态挤压以及拉伸变形至关重要。PTMCF神经导管具有较高的柔韧性,可以抵抗弯曲、扭转等变形而不被破坏且可回复至最初形状(图2d),因此使其比先前研究的压缩模量为470 MPa的硬PEG导管更容易在外科手术中缝合,并且PTMCF的模量与天然神经类似(450 kPa),显著优于目前常用于周围神经修复的可降解聚合物,其中包括PGS甲基丙烯酸酯(压缩模量3.2 MPa)、PCL(拉伸模量(E): 400 MPa)、聚乳酸(E: 680 MPa)和聚-3-羟基丁酸酯(E: 1160 MPa)。此外,热塑性聚合物如PCL制备的生物可吸收支架在植入前受到约束变形时容易产生应力松弛甚至永久变形,而热固性PTMCF交联网络在这方面要显著优于热塑性聚合物。综上所述:采用PTMC作为前驱体可以同时获得具有低模量、优异弹性可回复性以及可打印性的PTMCF网络。
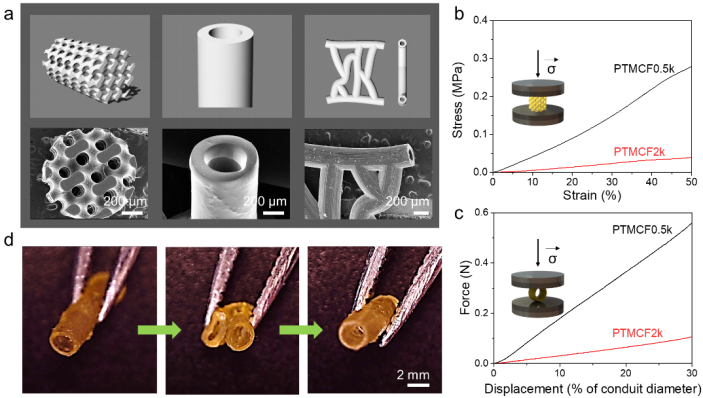
图2.(a)Gyroid支架、单通道神经导管和血管网络支架(从左至右)模型图以及相应的实物SEM图。(b)PTMCF2k神经导管的柔韧性展示。(c)PTMCF0.5k和2k的gyroid支架的压应力应变曲线,(d)神经导管径向压缩力-位移曲线。
三种PTMCF的基底具有相似的表面形貌、水接触角和蛋白吸附能力,但其模量会随着交联密度的增加而增加。因此,基于PTMCFs的基底和支架可用作研究模量对干细胞行为响应和体内软硬组织再生的优异平台。结果表明:在E为90-990 kPa范围内,hMSCs细胞粘附、铺展和增殖与模量呈正相关;而hMSCs成骨或神经元分化分别在990 kPa和90 kPa基底上会得到增强,模量通过介导YAP转录活性调控粘着斑蛋白形成以及后续的细胞行为。当支架压缩模量处于85-580 kPa范围内,大鼠股骨髁修复与支架模量呈正相关;而其周围神经修复与支架模量呈负相关(图3)。通过转录组学得到的模量介导周围神经修复潜在机制:适宜的模量可促进细胞整合素表达,激活FAK磷酸化并进一步活化Rho家族蛋白,从而激活下游蛋白以形成Arp2/3复合物,促进肌动蛋白成核与聚合,并形成丝状伪足、微突起和板状伪足,促进神经元生长并进一步修复周围神经。本论文不仅提供了一种优异的可3D打印生物弹性体的光固化树脂,而且提出了不同基底模量的范围是决定干细胞命运以及进一步硬/软组织再生的关键因素之一,并揭示了其潜在作用的机制。

图3. 大鼠(a)股骨缺损与(b)坐骨神经损伤造模与修复时间点及表征手段示意图。(c)Gyroid支架模量对大鼠股骨髁修复的影响。(d)3D打印神经导管的模量对大鼠周围神经再生的影响。
原文链接:
https://doi.org/10.1002/adhm.202301158